Les plantes terrestres ancestrales sont apparues il y a 410 millions d’années. Par rapport aux Algues vertes dont elles divergent, elles se caractérisent, en particulier, par une cuticule imperméable limitant la déshydratation et la protection des spores qui sont enfermées dans un sac avec une enveloppe. Les fougères et plantes alliées développent un port érigé, grâce aux tissus conducteurs et de soutien, et généralisent l’hétérosporie chez les taxons les plus évolués afin d’augmenter statistiquement le brassage génétique. ——-  Chez les fougères, ce sont des spores et non pas des grains de pollen qui sont dispersées. Plus fragiles, elles donneront dans des conditions favorables, une sorte de lamelle verte, un prothalle, qui produira des gamètes : ceux-ci après la fécondation permettront la croissance d’une nouvelle fougère. Ces étapes, en particulier la fécondation car les gamètes mâles nagent, ne peuvent se dérouler sans eau. Chez l’osmonde royale (Osmunda regalis), les spores sont produites sur des frondes (“feuilles”) spécialisées. ————– Chez les Gymnospermes qui apparaissent il y a 260 millions d’années, la fécondation est sécurisée et le brassage génétique facilité grâce à la graine et au grain de pollen chez les Gymnospermes. ——-
Chez les fougères, ce sont des spores et non pas des grains de pollen qui sont dispersées. Plus fragiles, elles donneront dans des conditions favorables, une sorte de lamelle verte, un prothalle, qui produira des gamètes : ceux-ci après la fécondation permettront la croissance d’une nouvelle fougère. Ces étapes, en particulier la fécondation car les gamètes mâles nagent, ne peuvent se dérouler sans eau. Chez l’osmonde royale (Osmunda regalis), les spores sont produites sur des frondes (“feuilles”) spécialisées. ————– Chez les Gymnospermes qui apparaissent il y a 260 millions d’années, la fécondation est sécurisée et le brassage génétique facilité grâce à la graine et au grain de pollen chez les Gymnospermes. ——-  Le pollen apparaît chez les Gymnospermes. La pollinisation (son transport) est assurée par le vent. Ici, un nuage de grains de pollen chez un pin. ——– Enfin, chez les Angiospermes, la survie et dispersion des semences sont assurés grâce au carpelle et à la double fécondation (50 M années). Les tendances de l’histoire évolutive sont donc : – la libération de la contrainte « eau » dans le cycle de vie des plantes ; – la facilitation du brassage génétique ; – la sécurisation de la fécondation et du développement de l’embryon ; – la mise en place de mécanismes assurant la survie et la dispersion de la descendance sexuée. Les plantes à fleurs ou Angiospermes sont les plantes terrestres qui sont différenciées le plus tardivement mais dont la radiation est la plus importante.
Le pollen apparaît chez les Gymnospermes. La pollinisation (son transport) est assurée par le vent. Ici, un nuage de grains de pollen chez un pin. ——– Enfin, chez les Angiospermes, la survie et dispersion des semences sont assurés grâce au carpelle et à la double fécondation (50 M années). Les tendances de l’histoire évolutive sont donc : – la libération de la contrainte « eau » dans le cycle de vie des plantes ; – la facilitation du brassage génétique ; – la sécurisation de la fécondation et du développement de l’embryon ; – la mise en place de mécanismes assurant la survie et la dispersion de la descendance sexuée. Les plantes à fleurs ou Angiospermes sont les plantes terrestres qui sont différenciées le plus tardivement mais dont la radiation est la plus importante.
Les relations entre les insectes et les plantes fleurs
Les plantes à fleurs constituent le groupe dont les relations avec les insectes sont les plus riches et diversifiées. Pour les insectes les plantes à fleurs peuvent servir : – de nourriture soit directement (nectar, sève, feuilles, bois) ou soit indirectement (déjections de pucerons, création de compost) ; – d’ abri soit directement (bambou, feuilles) soit après transformation de matériel végétal (cire des abeilles). ——-  Le pollen s’est agglutiné sur les pattes de cet insecte. Il sera déposé sur une autre fleur favorisant ainsi le brassage génétique et l’évolution de l’espèce. Photographie : Nathalie Faivre ———— A l’inverse, pour les plantes à fleurs les insectes peuvent servir : – de vecteurs de pollinisation pour les plantes à fleurs ; – de nourriture (plantes insectivores) ; – de transport des semences ; – de semeurs (fourmis semeuses ou sarcleuses). La pollinisation est la relation qui a permis le développement du plus grand nombre d’adaptations de part et d’autre.
Le pollen s’est agglutiné sur les pattes de cet insecte. Il sera déposé sur une autre fleur favorisant ainsi le brassage génétique et l’évolution de l’espèce. Photographie : Nathalie Faivre ———— A l’inverse, pour les plantes à fleurs les insectes peuvent servir : – de vecteurs de pollinisation pour les plantes à fleurs ; – de nourriture (plantes insectivores) ; – de transport des semences ; – de semeurs (fourmis semeuses ou sarcleuses). La pollinisation est la relation qui a permis le développement du plus grand nombre d’adaptations de part et d’autre.
Le pollen des plantes à fleurs entomophiles
Le grain de pollen est un gamétophyte, c’est-à-dire une “plante” produisant des gamètes, et non pas un gamète lui-même. Il est à comparer au prothalle des fougères. Quand son transport est assuré par les les insectes, il est de grande taille, à exine (paroi externe) ornementée pour faciliter la fixation sur le corps des insectes. Il est produit par des étamines souvent placées à l’intérieur d’une fleur colorée et bien visible, produisant du nectar. —–  Chez les sauges, les fleurs colorées et de grande taille attirent les insectes pollinisateurs. L’insecte en entrant dans la corolle fait basculer les étamines qui déposent le pollen sur leur dos. Photographie : Patrice Barboutie —— Les insectes assurent la fécondation de 84% des plantes cultivées et 80% des plantes sauvages. Ils transportent le pollen jusqu’à 2 km autour de la ruche pour les abeilles autour de la ruche (Ramsey et al., 1999). La distance normale de pollinisation d’un bourdon est comprise entre 70 et 631 m, même quand des champs de culture sont très proches (Osborne et al., 1999). A l’inverse, chez les plantes à fleurs pollinisées par le vent, le pollen est de petite taille, à exine lisse et produit dans des anthères pendantes et à filets longs dans des fleurs réduites et discrètes. ———
Chez les sauges, les fleurs colorées et de grande taille attirent les insectes pollinisateurs. L’insecte en entrant dans la corolle fait basculer les étamines qui déposent le pollen sur leur dos. Photographie : Patrice Barboutie —— Les insectes assurent la fécondation de 84% des plantes cultivées et 80% des plantes sauvages. Ils transportent le pollen jusqu’à 2 km autour de la ruche pour les abeilles autour de la ruche (Ramsey et al., 1999). La distance normale de pollinisation d’un bourdon est comprise entre 70 et 631 m, même quand des champs de culture sont très proches (Osborne et al., 1999). A l’inverse, chez les plantes à fleurs pollinisées par le vent, le pollen est de petite taille, à exine lisse et produit dans des anthères pendantes et à filets longs dans des fleurs réduites et discrètes. ———  Chez les graminées, la pollinisation est anémophile. Les fleurs sont discrètes (sépales et pétales sont absents) et les anthères sont fixées au filet par leur milieu, ce qui facilite leur balancement par le vent et la libération d’un pollen de petite taille et à paroi lisse. ———
Chez les graminées, la pollinisation est anémophile. Les fleurs sont discrètes (sépales et pétales sont absents) et les anthères sont fixées au filet par leur milieu, ce qui facilite leur balancement par le vent et la libération d’un pollen de petite taille et à paroi lisse. ———
Quelques exemples de pollinisations par les insectes
Chez les composées, le capitule, comme beaucoup d’inflorescences, a un effet d’affichage important dû à la multiplication des fleurs. Chez certaines composées, les fleurs périphériques étant stériles n’ont aucun rôle sexuel direct mais servent à guider les insectes vers celles fertiles placées au centre de l’inflorescence. Après la fécondation, le fruit est transporté par le vent ou les animaux. Chez les légumineuses papilionacées, les inflorescences ne sont pas en capitule mais la forme particulière de la corolle, étendard surplombant la carène et 2 ailes latérales, conduit les insectes vers les organes sexuels de la fleur. Chez les orchidées, l’attraction des insectes pollinisateurs est due à différents facteurs : – la production de nectar (genres Spiranthes et Orchis ) ; – l’éperon qui joue, comme cela a été prouvé, un rôle important ; – le mimétisme avec les plantes à nectar (genre Orchis ) ; – le leurre sexuel (genre Ophrys ). Une fois l’insecte attiré par la fleur, la morphologie de celle ci permet la fixation du pollen sur le corps de l’animal, son transport puis son dépôt sur l’organe femelle de la fleur, le stigmate du pistil, qui est pollinisé ensuite (cas de Orchis morio). —–  Chez Ophrys scolopax, le labelle imite la forme de l’insecte pollinisateur. L’insecte mâle est adulte avant la femelle. Il participe à la pollinisation car il est attiré par un bouquet d’odeur similaire à la phéromone sexuelle de la femelle. —— Chez les orchidées, d’autres facteurs peuvent intervenir sur la pollinisation : morphologie de l’inflorescence (spiranthe d’été) ou position des fleurs dans l’inflorescence (spiranthe d’automne). L’hybridation interspécifique est possible (orchis singe et orchis homme pendu) car le pollinisateur est commun entre ces deux espèces Chez les aracées, les insectes pollinisateurs sont attirés par l’odeur nauséabonde émise par l’inflorescence, un spadice enveloppé d’une spathe. Les fleurs femelles situées vers le bas de l’inflorescence sont fertiles avant les fleurs mâles (protogynie). Il existe aussi des fleurs stériles, mâles ou femelles, réglant le passage des insectes d’un niveau à l’autre du spadice. Chez Arum italicum, les insectes chargés de pollen sont bloqués au niveau de l’ampoule de la spathe par des fleurs stériles pour permettre la pollinisation et la fécondation des fleurs femelles fertiles. Ceci étant fait, les insectes peuvent remonter au niveau des fleurs mâles devenues fertiles entre temps, se chargent à nouveau de pollen. Quand les appendices des fleurs mâles stériles se flétrissent à leur tour, ils peuvent quitter la spathe qui les piégeaient pour polliniser une autre plante (allopollinisation). Chez les moracées, la pollinisation des figuiers est particulière. Les 800 espèces de figuiers de par le monde ont chacun un mutualisme de pollinisation spécifique et obligatoire avec un hyménoptère, une Agaronide. Les inflorescences des figuiers sont protogynes, comme celles des aracées : les fleurs femelles sont fertiles avant les mâles. Les larves se développent au sein de fleurs femelles stériles qui se développent en galle. A maturité, les insectes s’envolent et avant de quitter l’inflorescence se chargent de pollen au contact des fleurs mâles fertiles. Quand les insectes femelles vont pondre dans les jeunes inflorescences de figuier, seules les fleurs femelles sont fertiles et elles recevront le pollen que les insectes avaient pris dans l’inflorescence précédente. D’autres acteurs participent à ce mutualisme : des insectes parasites des pollinisateurs et des fourmis prédatrices attirées aussi bien par les parasites et les pollinisateurs que par des messages chimiques olfactifs évoquant des hormones sexuelles. Les relations entre les insectes et les plantes à fleurs sont anciennes Chez les Angiospermes ancestrales, la pollinisation déjà était assurée par des Coléoptères qui mangeaient le pollen. Elles sont devenues complexes et diversifiées, permettent d’offrir le gîte et le couvert pour les insectes et d’assurer la pollinisation de 80% des plantes à fleurs. Chacune des parties, l’animal ou la plante, pouvant posséder des caractères morphologiques adaptés à l’autre partie, certaines relations sont uniquement spécifiques. Certains auteurs n’hésitent donc pas à qualifier les relations entre les insectes et les plantes à fleurs de co-évolution. Quelle que soit leur différentes qualifications (co-évolution, mutualisme…) liées à leur degré de complexité, ces relations privilégiées expliquent sans doute la radiation importante des Angiospermes alors que le groupe est récent par rapport aux autres plantes terrestres.
Chez Ophrys scolopax, le labelle imite la forme de l’insecte pollinisateur. L’insecte mâle est adulte avant la femelle. Il participe à la pollinisation car il est attiré par un bouquet d’odeur similaire à la phéromone sexuelle de la femelle. —— Chez les orchidées, d’autres facteurs peuvent intervenir sur la pollinisation : morphologie de l’inflorescence (spiranthe d’été) ou position des fleurs dans l’inflorescence (spiranthe d’automne). L’hybridation interspécifique est possible (orchis singe et orchis homme pendu) car le pollinisateur est commun entre ces deux espèces Chez les aracées, les insectes pollinisateurs sont attirés par l’odeur nauséabonde émise par l’inflorescence, un spadice enveloppé d’une spathe. Les fleurs femelles situées vers le bas de l’inflorescence sont fertiles avant les fleurs mâles (protogynie). Il existe aussi des fleurs stériles, mâles ou femelles, réglant le passage des insectes d’un niveau à l’autre du spadice. Chez Arum italicum, les insectes chargés de pollen sont bloqués au niveau de l’ampoule de la spathe par des fleurs stériles pour permettre la pollinisation et la fécondation des fleurs femelles fertiles. Ceci étant fait, les insectes peuvent remonter au niveau des fleurs mâles devenues fertiles entre temps, se chargent à nouveau de pollen. Quand les appendices des fleurs mâles stériles se flétrissent à leur tour, ils peuvent quitter la spathe qui les piégeaient pour polliniser une autre plante (allopollinisation). Chez les moracées, la pollinisation des figuiers est particulière. Les 800 espèces de figuiers de par le monde ont chacun un mutualisme de pollinisation spécifique et obligatoire avec un hyménoptère, une Agaronide. Les inflorescences des figuiers sont protogynes, comme celles des aracées : les fleurs femelles sont fertiles avant les mâles. Les larves se développent au sein de fleurs femelles stériles qui se développent en galle. A maturité, les insectes s’envolent et avant de quitter l’inflorescence se chargent de pollen au contact des fleurs mâles fertiles. Quand les insectes femelles vont pondre dans les jeunes inflorescences de figuier, seules les fleurs femelles sont fertiles et elles recevront le pollen que les insectes avaient pris dans l’inflorescence précédente. D’autres acteurs participent à ce mutualisme : des insectes parasites des pollinisateurs et des fourmis prédatrices attirées aussi bien par les parasites et les pollinisateurs que par des messages chimiques olfactifs évoquant des hormones sexuelles. Les relations entre les insectes et les plantes à fleurs sont anciennes Chez les Angiospermes ancestrales, la pollinisation déjà était assurée par des Coléoptères qui mangeaient le pollen. Elles sont devenues complexes et diversifiées, permettent d’offrir le gîte et le couvert pour les insectes et d’assurer la pollinisation de 80% des plantes à fleurs. Chacune des parties, l’animal ou la plante, pouvant posséder des caractères morphologiques adaptés à l’autre partie, certaines relations sont uniquement spécifiques. Certains auteurs n’hésitent donc pas à qualifier les relations entre les insectes et les plantes à fleurs de co-évolution. Quelle que soit leur différentes qualifications (co-évolution, mutualisme…) liées à leur degré de complexité, ces relations privilégiées expliquent sans doute la radiation importante des Angiospermes alors que le groupe est récent par rapport aux autres plantes terrestres.



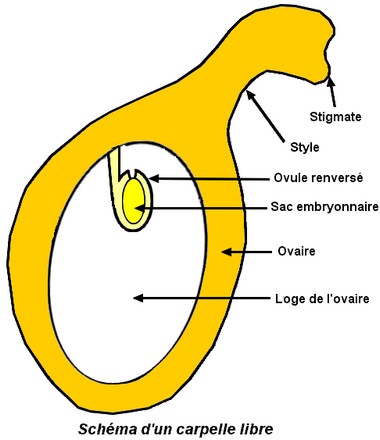
 Iris pseudoacorus ou Iris faux-acore est une espèce française omniprésente dnas les zones humides. ——- Lors de la pollinisation, les abeilles sont attirées par le nectar secrété par des glandes situées à la base des sépales. En passant entre les sépales et les lobes stigmatiques, elles frottent leur dos qui porte du pollen d’une autre fleur sur les stigmates. Après avoir prélevé le nectar, en ressortant de la fleur, elles prélèvent du pollen de la fleur qu’elles viennent juste de butiner. Le pollen déposé sur les stigmates va alors développer un long tube pollinique qui portera à son extrémité les gamètes mâles à l’intérieur des loges de l’ovaire. Ceux-ci féconderont les gamètes femelles situés dans l’ovule. Cette méthode de pollinisation favorise la fécondation entre 2 individus différents et limitent l’auto-fécondation alors que les fleurs sont hermaphrodites. Le brassage génétique permet l’apparition de nouvelles combinaisons génétiques, augmente ainsi la diversité de l’espèce et sa possibilité d’avoir des individus adaptés à leur milieu de vie. Après la fécondation, l’ovaire se transforme en un fruit sec déhiscent, une capsule, s’ouvrant par des fentes traversant les parois entre carpelles (capsule loculicide ). Les ovules se transforment en graines ; la placentation est axile . ——- – Voir l’article
Iris pseudoacorus ou Iris faux-acore est une espèce française omniprésente dnas les zones humides. ——- Lors de la pollinisation, les abeilles sont attirées par le nectar secrété par des glandes situées à la base des sépales. En passant entre les sépales et les lobes stigmatiques, elles frottent leur dos qui porte du pollen d’une autre fleur sur les stigmates. Après avoir prélevé le nectar, en ressortant de la fleur, elles prélèvent du pollen de la fleur qu’elles viennent juste de butiner. Le pollen déposé sur les stigmates va alors développer un long tube pollinique qui portera à son extrémité les gamètes mâles à l’intérieur des loges de l’ovaire. Ceux-ci féconderont les gamètes femelles situés dans l’ovule. Cette méthode de pollinisation favorise la fécondation entre 2 individus différents et limitent l’auto-fécondation alors que les fleurs sont hermaphrodites. Le brassage génétique permet l’apparition de nouvelles combinaisons génétiques, augmente ainsi la diversité de l’espèce et sa possibilité d’avoir des individus adaptés à leur milieu de vie. Après la fécondation, l’ovaire se transforme en un fruit sec déhiscent, une capsule, s’ouvrant par des fentes traversant les parois entre carpelles (capsule loculicide ). Les ovules se transforment en graines ; la placentation est axile . ——- – Voir l’article  Comme d’autres espèces d’araucarias, le pin du Parana est dioïque, on distingue des pieds mâles et des pieds femelles. Les cônes mâles sont présents d’août à janvier, ils produisent le pollen, transporté par le vent. Les cônes femelles sont présents toute l’année sur les arbres de plus de 10 ans. Il faut 2 ans après la fécondation pour la maturation des cônes femelles. Les semences charnues sont constituées des ovules fécondés soudés aux écailles. Elles sont consommées par les populations locales. Chaque arbre femelle produit en moyenne 40 cônes femelles chaque année durant sa vie (plus de 200 ans).
Comme d’autres espèces d’araucarias, le pin du Parana est dioïque, on distingue des pieds mâles et des pieds femelles. Les cônes mâles sont présents d’août à janvier, ils produisent le pollen, transporté par le vent. Les cônes femelles sont présents toute l’année sur les arbres de plus de 10 ans. Il faut 2 ans après la fécondation pour la maturation des cônes femelles. Les semences charnues sont constituées des ovules fécondés soudés aux écailles. Elles sont consommées par les populations locales. Chaque arbre femelle produit en moyenne 40 cônes femelles chaque année durant sa vie (plus de 200 ans).  Les cônes femelles matures pèsent jusqu’à 5 kg, avec 150 semences en moyenne par kg. Les semences perdent leur capacité germinative après 120 jours. Elles sont riches en amidon (57% des réserves) et en acides aminés. —– Références -Angeli A, 2003. Araucaria angustifolia (Araucaria). Instituto de Pesquisas e Estudos Florestais. Site www.ipef.br . -Chaw SM, Zharkikh A, Sung HM, Lau TC, Li WH, 1997. Biology and Evolution Molecular phylogeny of extant gymnosperms and seed plant evolution: analysis of nuclear 18S rRNA sequences. Molecular Biology and Evolution, Vol 14, 56-68. -Setoguchi Hiroaki, Takeshi Asakawa Osawa, Pintaud J-C, Jaffré T, Veillon J-M, 1998. Phylogenetic relationships within Araucariaceae based on rbcL gene sequences. American Journal of Botany 85(11): 1507-1516.
Les cônes femelles matures pèsent jusqu’à 5 kg, avec 150 semences en moyenne par kg. Les semences perdent leur capacité germinative après 120 jours. Elles sont riches en amidon (57% des réserves) et en acides aminés. —– Références -Angeli A, 2003. Araucaria angustifolia (Araucaria). Instituto de Pesquisas e Estudos Florestais. Site www.ipef.br . -Chaw SM, Zharkikh A, Sung HM, Lau TC, Li WH, 1997. Biology and Evolution Molecular phylogeny of extant gymnosperms and seed plant evolution: analysis of nuclear 18S rRNA sequences. Molecular Biology and Evolution, Vol 14, 56-68. -Setoguchi Hiroaki, Takeshi Asakawa Osawa, Pintaud J-C, Jaffré T, Veillon J-M, 1998. Phylogenetic relationships within Araucariaceae based on rbcL gene sequences. American Journal of Botany 85(11): 1507-1516.